Kurzbeschrieb
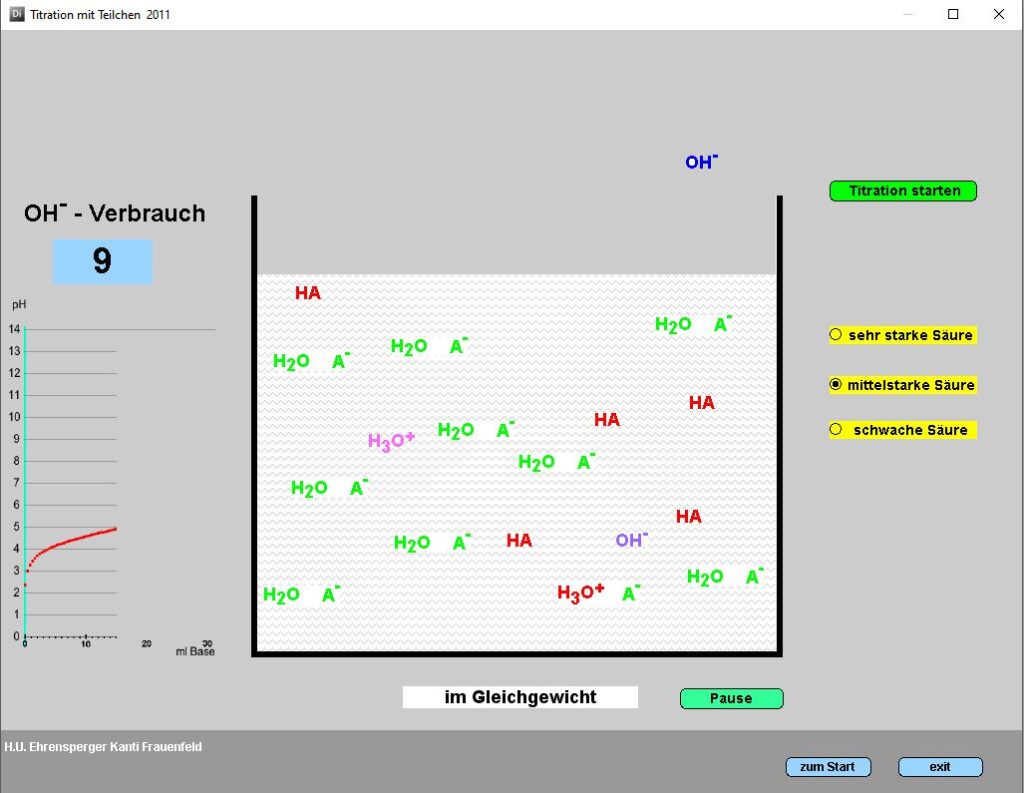
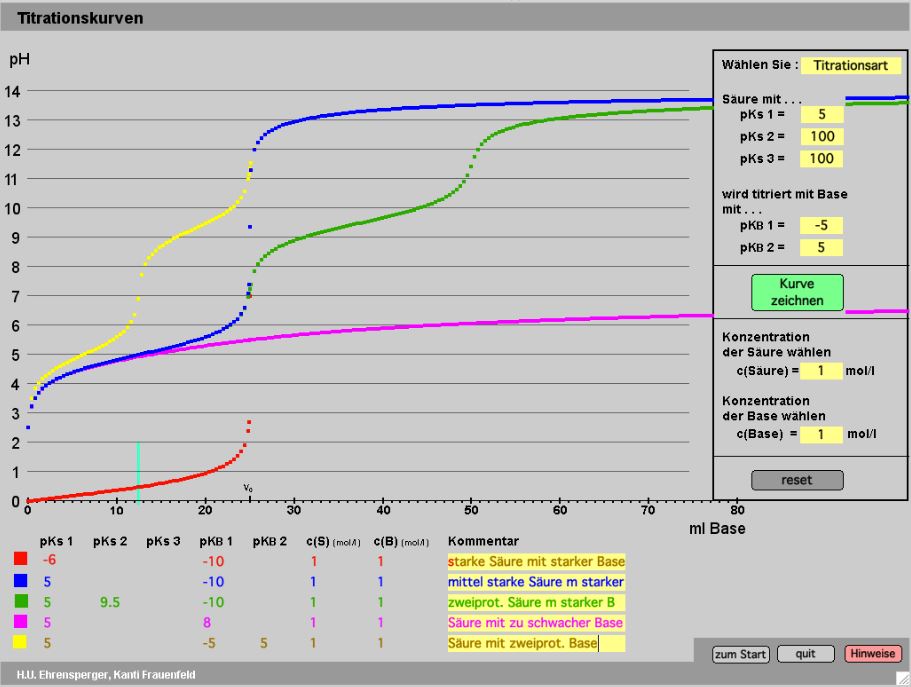
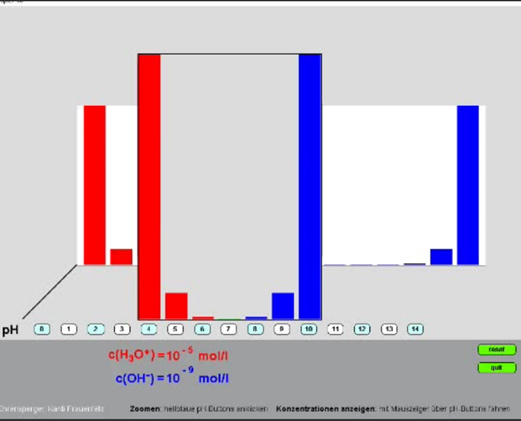
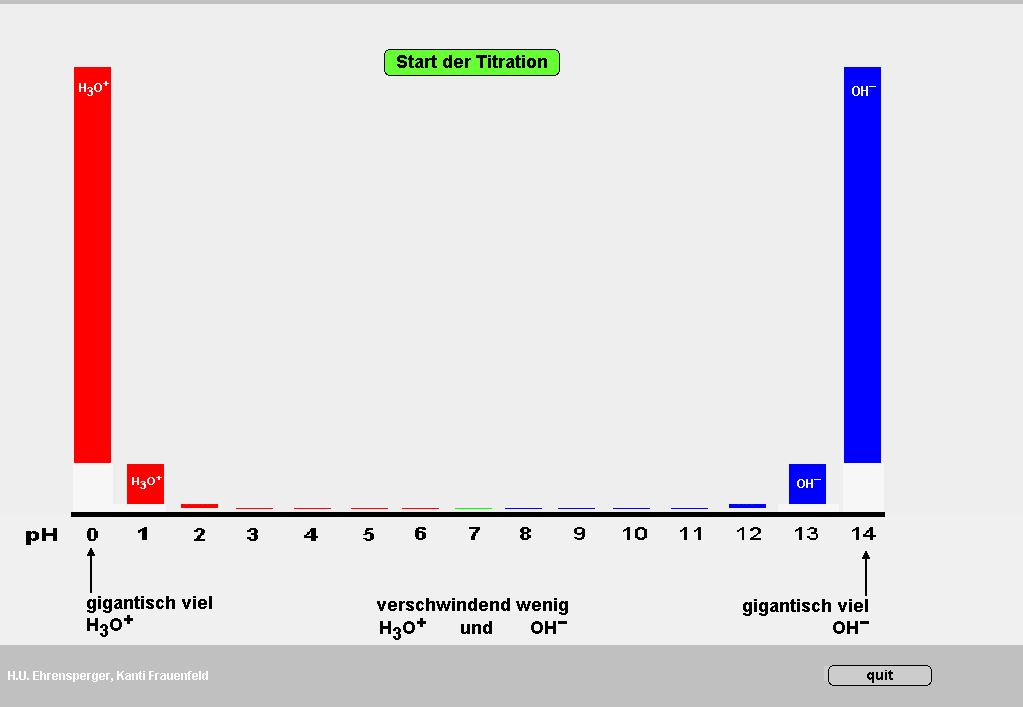
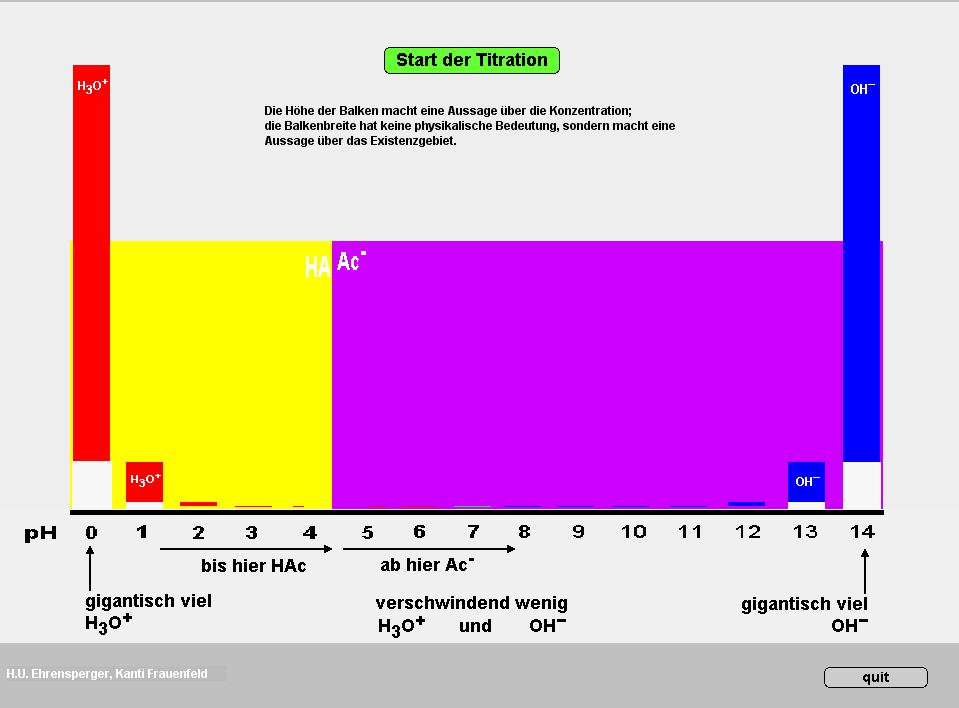
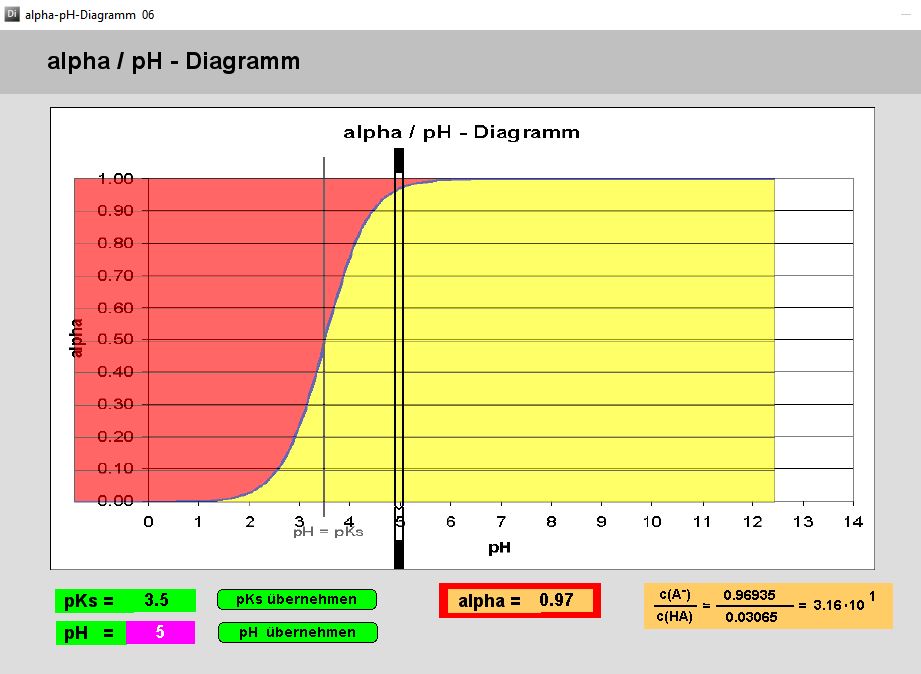
Das Programm ermittelt den Anteil der deprotonierten Form einer Säure an der Gesamtkonzentration (alpha) als Funktion des pKS-Wertes und des pH-Wertes.
Einsatz im Unterricht
Der alpha-Wert ist eine äusserst bequeme Grösse, welche das Verständnis der Pufferwirkung, der pH-Berechnung und der Titration enorm erleichtert.
Hinweise
Durch Eingabe des pKs-Wertes oder durch einfaches Verschieben der Sigmoide mit linker Maustaste lässt sich jede Säure darstellen. Jetzt kann man die schwarze pH-Marke verschieben (linke Maustaste) oder den pH-Wert direkt eingeben: sofort erscheinen die Grössen c(A–)/c(HA) und der alpha-Wert = c(A–)/[(c(HA) + c(A–)]), das heisst der Anteil der deprotonierten Form an der Summe der beiden Formen.