Archiv des Autors: Hans Ueli Ehrensperger
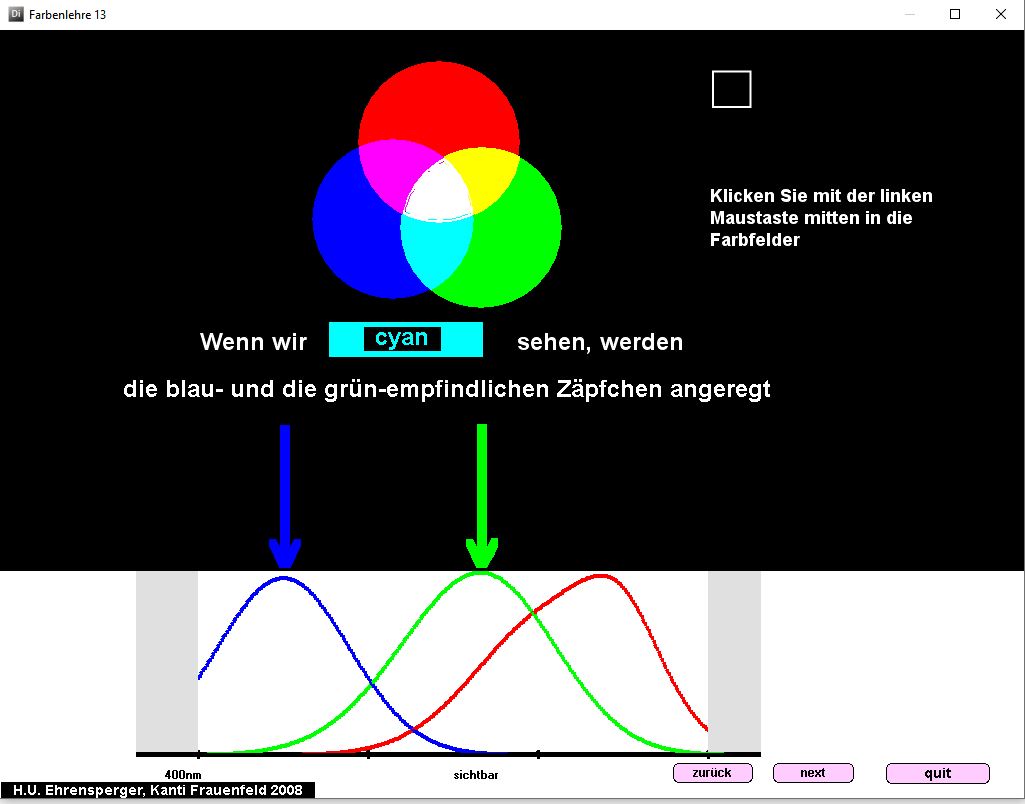
Farbenlehre
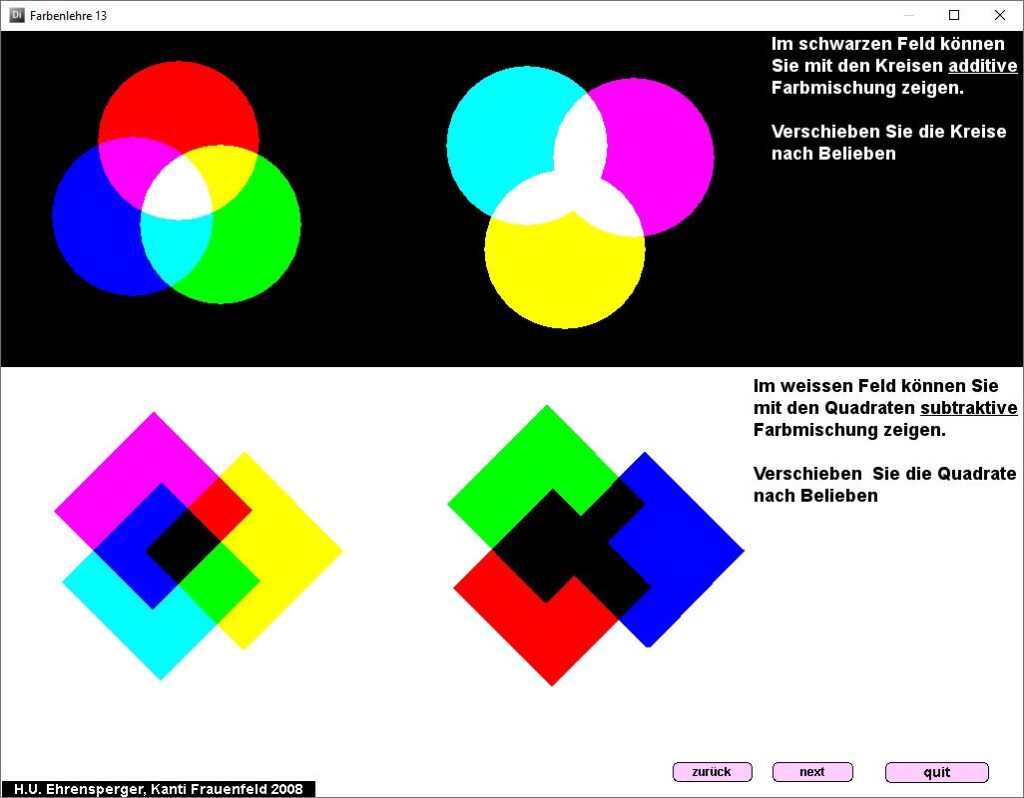
Kurzbeschrieb
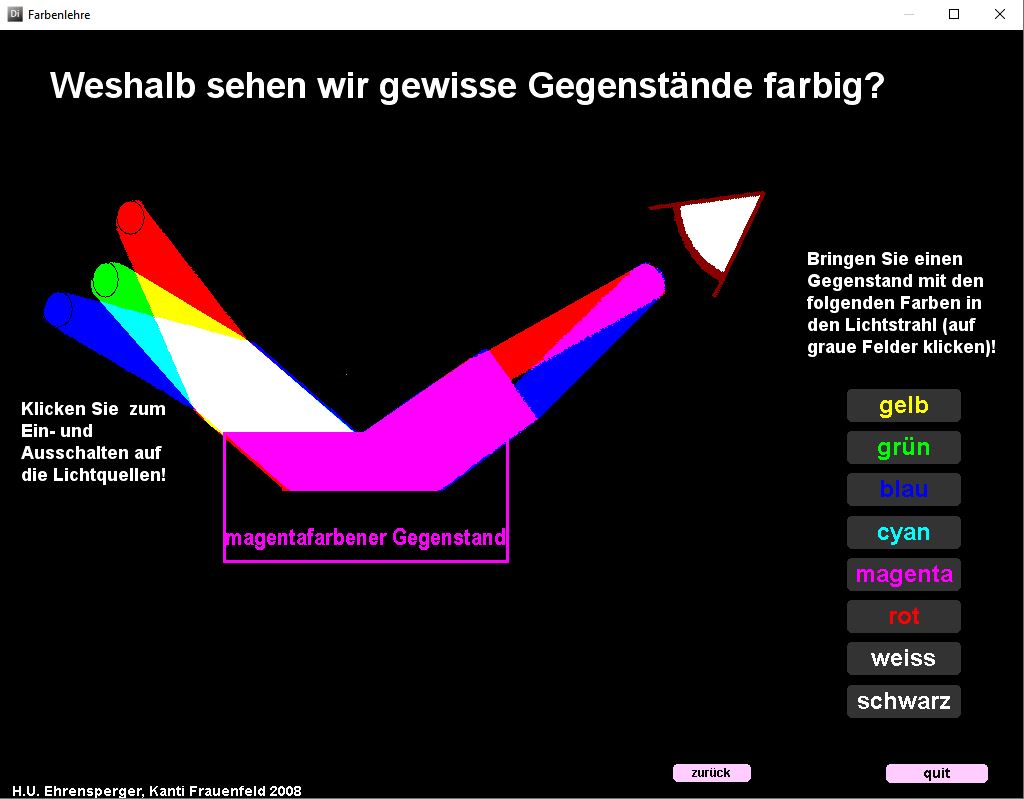
Das Programm «Farbenlehre» zeigt Zusammenhänge bei der additiven und subtraktiven Farbmischung und beim Farbensehen.
Einbau im Unterricht
Das Programm «Farbenlehre» eignet sich beim Thema «Auge», «Farbensehen» für die Demonstration im Klassenverband und v.a. als Postenarbeit .
Hinweise
Additive und subtraktive Farbmischung kann durch Verschieben von farbigen Formen dargestellt werden (vgl. obige Abbildung). Der Zusammenhang zwischen Farbempfindung und Anregung der drei Zäpfchenarten wird aufgezeigt. Welche Farbe wird von einem Gegenstand absorbiert, wenn wir ihn farbig sehen?
Photosynthese II
Kurzbeschrieb
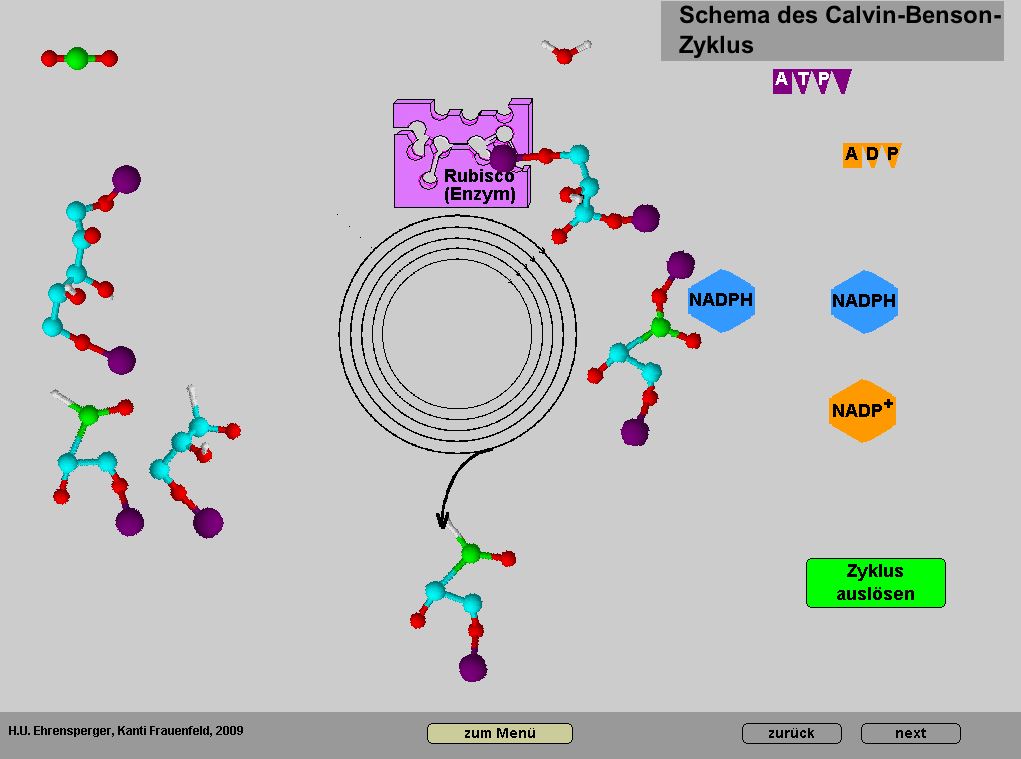
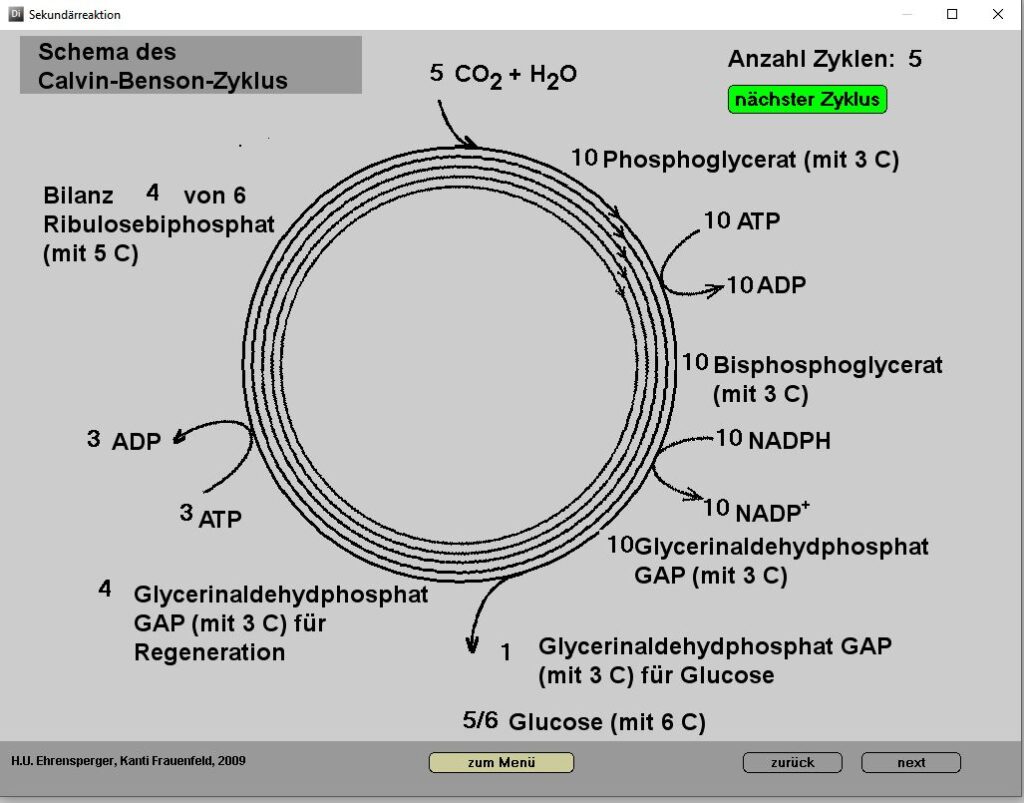
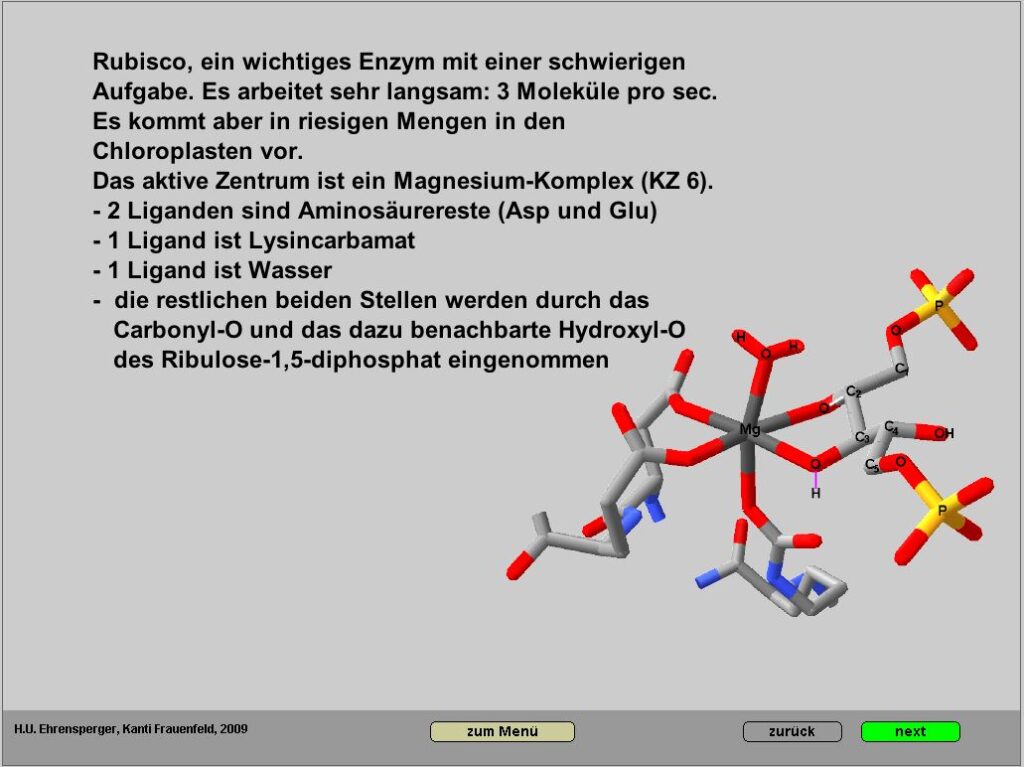
Ausführliche Darstellung der Sekundärreaktion der Photosynthese
Einbau in den Unterricht
Es ist sinnvoll, einzelne Sequenzen zur Visualisierung von Teilvorgängen einzusetzen. Ein wichtiges Ziel war es, zu zeigen, dass der Gesamtvorgang zwar ausgesprochen kompliziert ist, einzelne Schritte aber auch für das Mittelschulniveau durchaus nachvollziehbar sind. Dieser Teil des Themas Photosynthese enthält recht viel Chemie, wiederum aber leicht verständlich.
Hinweis
Das Programm geht über den Mittelschulstoff hinaus. Es ist aber stark strukturiert, so dass leicht navigiert werden kann.
Photosynthese I
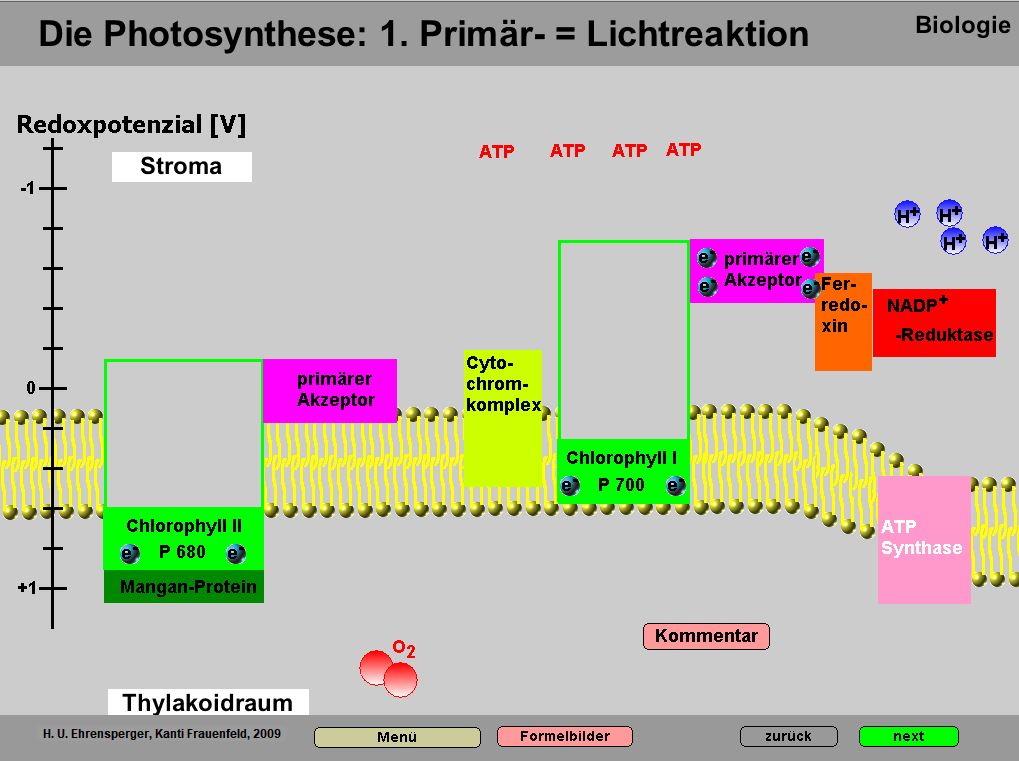
Kurzbeschrieb
Das Programm zeigt ausführlich die physikalischen, chemischen und vor allem biologischen Grundlagen der Primärreaktion der Photosynthese
Einsatz im Unterricht
Das Programm eignet sich sehr gut, um die physikalischen und chemischen Voraussetzungen aufzuzeigen. Es ist sehr stark strukturiert, so dass es sehr gut einzelne Schritte der komplexen biologischen Vorgänge zu visualisieren vermag
Hinweise
Das Programm geht über den Mittelschulstoff hinaus. Er ist aber so gestaltet, dass man nach Belieben navigieren und Seitenpfade überspringen kann. Ein wichtiges Ziel war es, zu zeigen, dass der Gesamtvorgang zwar ausgesprochen kompliziert ist, einzelne Schritte aber auch für das Mittelschulniveau durchaus nachvollziehbar sind.
Enzymanimation Chymotrypsin
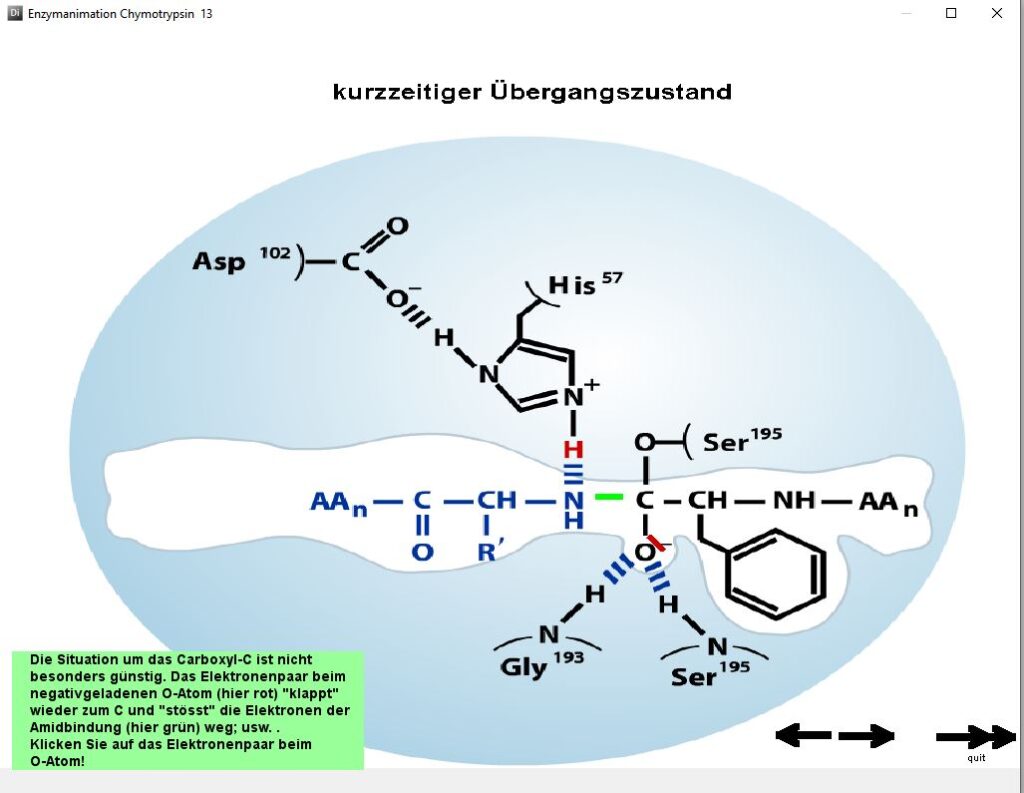
(Grundlage:http://bcs.whfreeman.com/lehninger)
Kurzbeschrieb
Beschreibt ausführlich mit vielen Nutzeraktivitäten einen möglichen Mechanismus der Proteinspaltung mit Hilfe des Enzyms Chymotropsin.
Einsatz im Unterricht
Demonstration im Klassenverband für eine typische Proteaseaktivität oder im Selbststudium.
Hinweise
Das an sich komplexe Geschehen wird in einzelne auch für Mittelschülerinnen und Mittelschüler verständliche Teilschritte zerlegt. Es wird augenfällig, weshalb Chymotrypsin nur spezifische Bindungen spalten kann (hydrophobe Tasche).
Beachten Sie, dass grün-hinterlegte Hinweise und Pfeile eine Aktivität des Nutzers bzw. der Nutzerin verlangen.
Potenzialschema im Bleiakku

Kurzhinweis
Das Programm zeigt Änderungen der Potenziale bei der Serieschaltung und lässt die Potenzialdifferenz zwischen zwei beliebigen Punkten im Bleiakku abgreifen.
Einsatz im Unterricht
Visualisierung der Serieschaltung. Darstellung der Tatsache, dass man zwar das Einzel-Potenzial einer Lösung nicht bestimmen kann, Potenzialdifferenzen zwischen den Lösungen durchaus berechenbar sind, nicht aber zwischen einer Lösung und einer Elektrode.
Hinweise
Man beachte: es werden Potenzialdifferenzen angezeigt und nicht messbare Spannungen.
Als Ausschnitt aus einem Bleiakku lassen sich 3 Zellen in Serie schalten. Man beachte, dass sich dabei auch die Potenziale der Lösungen verändern. Die Potenziale der Lösungen gegenüber den Elektroden sind nicht bekannt; sie lassen sich also beliebig wählen (mit linker Maustaste verschieben). Im dritten Bild können die Potenzialdifferenzen gemessen werden.
Brennstoffzelle

Kurzbeschrieb
Das Programm zeigt den Bau und die Funktionsweise einer Brennstoffzelle
Einsatz im Unterricht
Visualisierung der Funktion bei der Besprechung der Brennstoffzelle
Hinweis
Man kann den gedanklichen „Werdegang“ verfolgen oder vom ersten Bild aus direkt zur Funktionsweise der Brennstoffzelle gelangen.
alpha/pH-Diagramm
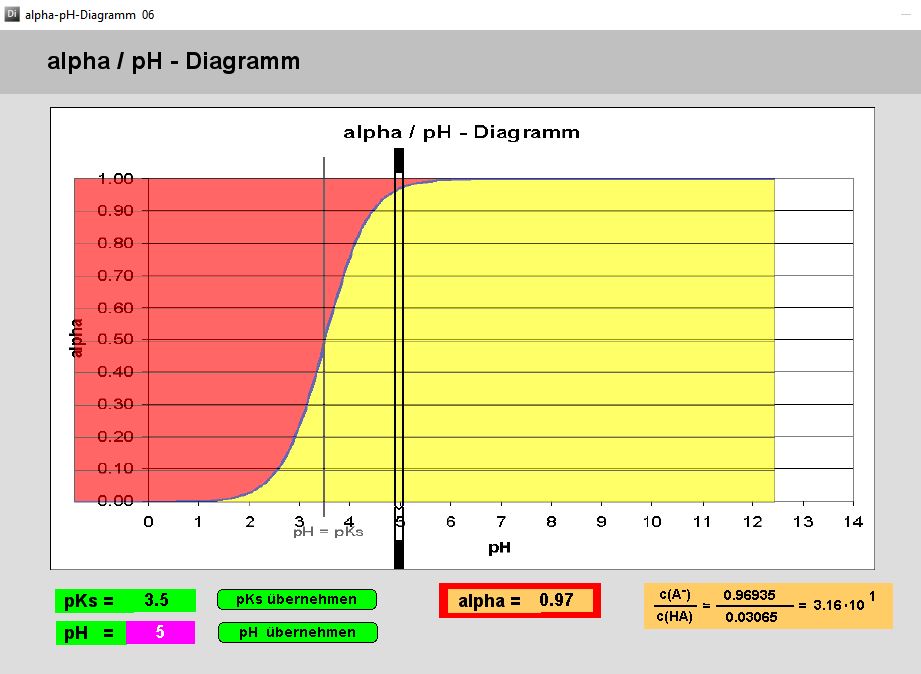
Kurzbeschrieb
Das Programm ermittelt den Anteil der deprotonierten Form einer Säure an der Gesamtkonzentration (alpha) als Funktion des pKS-Wertes und des pH-Wertes.
Einsatz im Unterricht
Der alpha-Wert ist eine äusserst bequeme Grösse, welche das Verständnis der Pufferwirkung, der pH-Berechnung und der Titration enorm erleichtert.
Hinweise
Durch Eingabe des pKs-Wertes oder durch einfaches Verschieben der Sigmoide mit linker Maustaste lässt sich jede Säure darstellen. Jetzt kann man die schwarze pH-Marke verschieben (linke Maustaste) oder den pH-Wert direkt eingeben: sofort erscheinen die Grössen c(A–)/c(HA) und der alpha-Wert = c(A–)/[(c(HA) + c(A–)]), das heisst der Anteil der deprotonierten Form an der Summe der beiden Formen.
Titration mit Teilchen
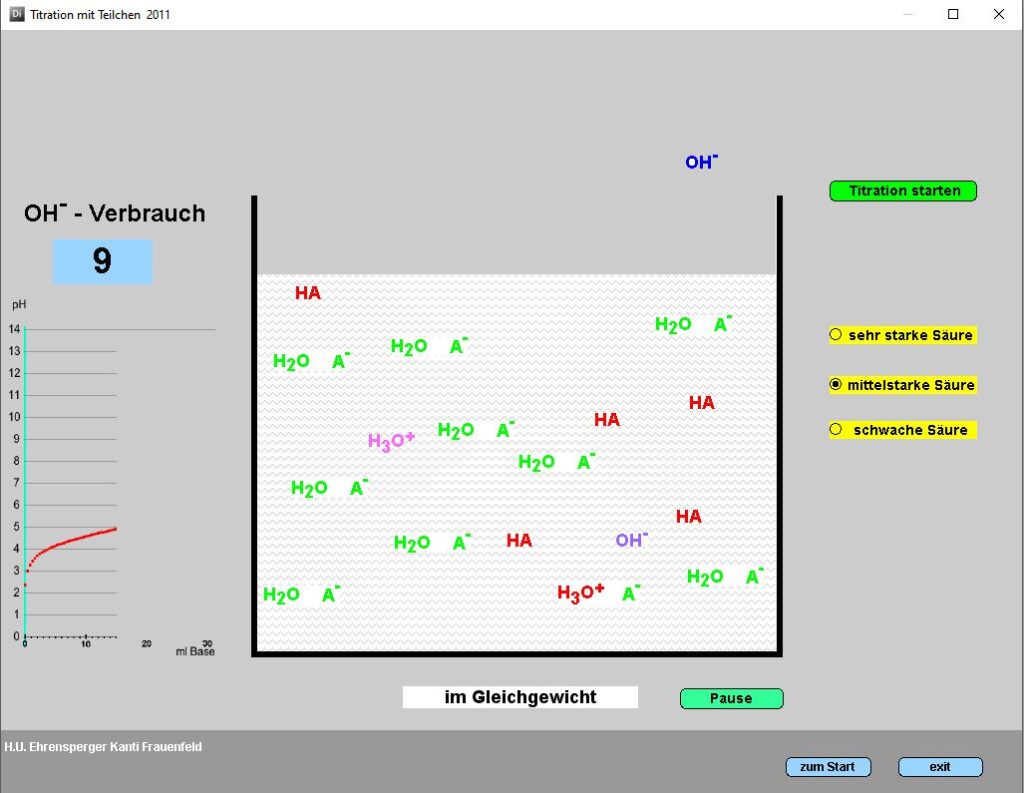
Kurzbeschrieb
Zeigt schematisch das Prinzip der Titration für Säuren unterschiedlicher Säurestärke.
Einsatz im Unterricht
Als Einstieg zur Erklärung der Titration. Zeigt, dass Titration eigentlich ein «chemisches Abzählen» ist und dass der Titrationsendpunkt nicht immer bei pH = 7 gewählt werden kann.
Hinweis
OH– reagiert in der Darstellung nicht nur mit H3O+, sondern auch mit der protonierten Form der Säure. Für „Puristen“ sei der Hinweis gestattet,
dass H3O+ bei pH 5 zwar immer noch die
stärkste Säure ist, aber in über 33’000 mal
kleinerer Konzentration vorkommt als z.B.
das Essigsäuremolekül in einer Essigsäurelösung mit c(HAc) = 1 mol/l.
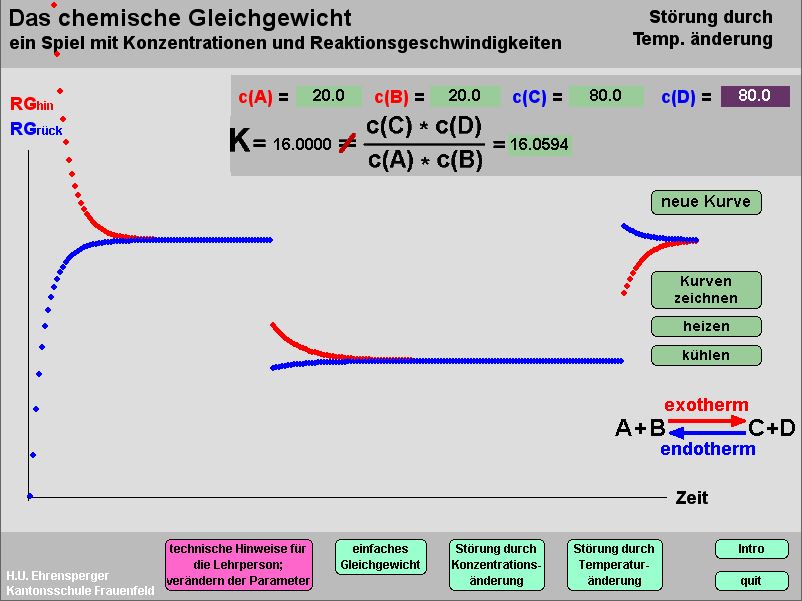
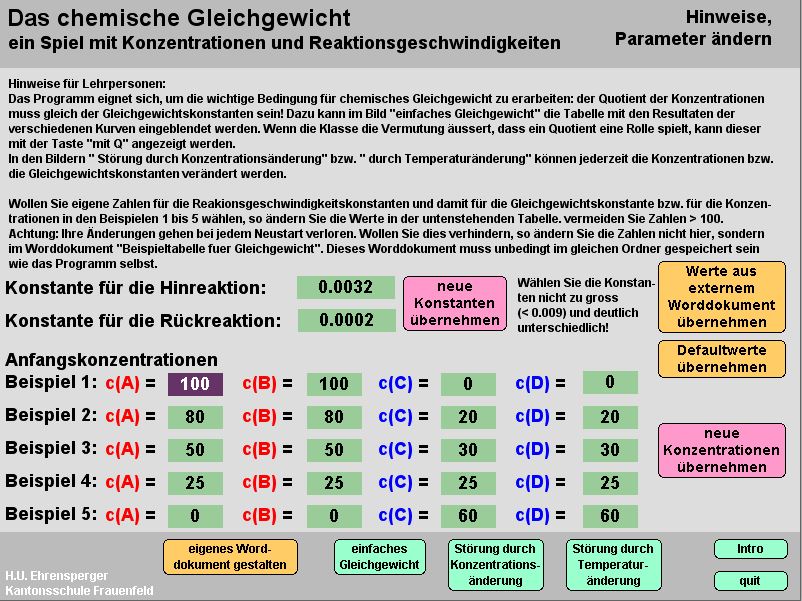
Gleichgewicht
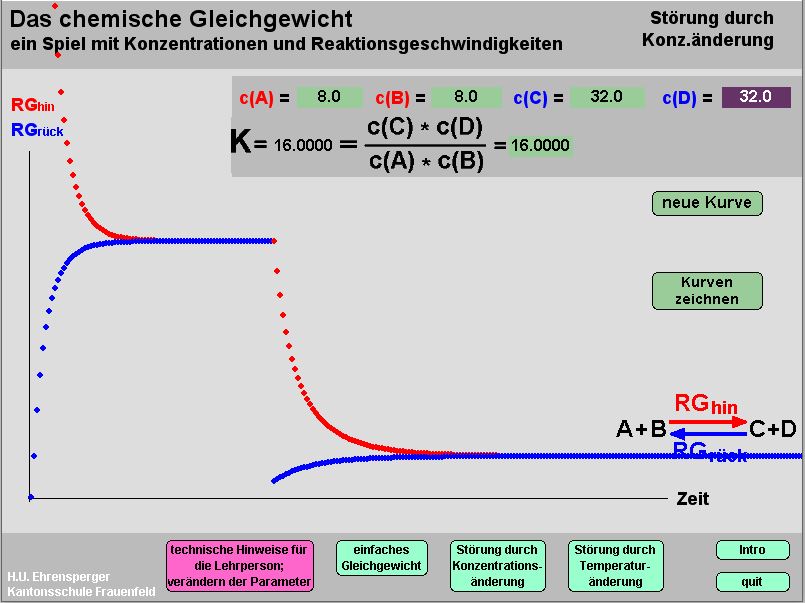
Kurzbeschrieb
Das Programm zeichnet Reaktionsgeschwindigkeit/ Zeit-Diagramme auf. Sämtliche Konzentrationen können jederzeit geändert werden; heizen und abkühlen können durch Änderung der Massenwirkungskonstanten simuliert werden.
Einsatz im Unterricht
Es werden die notwenigen (rev. Reaktion, isol. System) und die notwendigen und hinreichenden Bedingungen für das chemische Gleichgewicht erarbeitet. Die letzte Bedingung, nämlich dass der Konzentrationsquotient gleich einer Konstanten sein muss, lässt man an Hand des Programms erforschen. In anschliessenden Lektionen werden Folgen der Störung des Gleichgewichtes im Experiment selbst erlebt und mit Hilfe des Programms erklärt.
Hinweise
Das Programm ist dreigeteilt. Zuerst erkennen die Lernenden, dass die Konzentrationen im Gleichgewicht gewissen Regeln genügen (Konzentrationen im Gleichgewichtszustand lassen sich mit „Resultate zeigen“ darstellen und entfernen); sobald der Quotient als Kriterium erkannt ist, kann er mit der Taste „mit Q“ eingeblendet werden: jetzt ist Gleichgewicht dann erreicht, wenn. Q = K.
Störung durch Konzentrationsänderung: man lässt ein beliebiges Beispiel zum Gleichgewicht kommen (Kurven zeichnen); jetzt ändert man beliebige Konzentrationen (man entfernt z.B. alle A) ; mit „Kurven zeichnen“ werden die neuen RG gezeichnet, bis sich wieder Gleichgewicht eingestellt hat. Man beachte: K bleibt immer gleich.
Temperaturänderung: Man lässt wieder ein Beispiel zum Gleichgewicht kommen. Durch Temperaturänderung werden beide RG grösser oder kleiner, aber in unterschiedlichem Masse. Die Massenwirkungskonstante K wird verändert. Es muss sich ein neues Gleichgewicht einstellen.
wichtige Info!
Die Beispiele kann die Lehrperson auf der Datei «Beispieltabelle fuer Gleichgewicht» bei der Vorbereitung selbst zusammenstellen. Achtung: diese Datei muss unbedingt im gleichen Ordner als „doc“ gespeichert und geschlossen sein..